オリゴヌクレオチド合成の基本 その2:オリゴの自社生産に必要な4つのポイント

本記事は、オリゴヌクレオチド合成のベストプラクティスに関する3部構成の教育シリーズの2つ目のブログ記事です。
オリゴヌクレオチド合成の基礎の最初のブログ記事では、ホスホロアミダイト化学について紹介し、自社および外注生産のオリゴ合成における考慮点について述べました。今回は、引き続きオリゴヌクレオチド合成を取り上げ、合成サイクルの各ステップにおける重要なポイントについて考察していきます。
デブロッキング(脱トリチル化)
担体結合したヌクレオシドまたは修飾剤を用いて、オリゴヌクレオチド合成サイクルの最初のステップは、デブロッキングまたは脱トリチル化です。これは、ヌクレオシドの5'位または修飾剤の骨格からジメトキシトリチル保護基を酸処理で除去し、反応性のOH基を生成するものです。4,4'-ジメトキシトリチル(DMTr)保護基は、特にホスホロアミダイトにおいて、カップリング工程での自己カップリングを防止するために必要です。
DMTrはジクロロ酢酸(DCA)やトリクロロ酢酸(TCA)で容易に除去できるため、OH基の保護によく使用されます。しかし、酸との長時間の接触は、特にpolyA配列や敏感なヌクレオシドを含むオリゴヌクレオチドを組み立てる際に、脱プリンなどの副反応を引き起こすことがあります。脱プリンに弱い塩基の例としては、N(6)-ベンゾイル-2-デオキシアデノシン、2-デオキシグアノシンの8-アリール誘導体、さらにN(2)-イソブチリル-2-デオキシグアノシンがあります1。
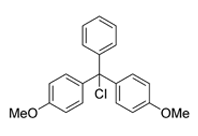
4,4-ジメトキシトリチルクロリド(DMTr-Cl)ヌクレオシドに反応性DMT官能基を形成するための試薬です。
脱プリンは、塩基性条件下では鎖の切断につながることがあります。例えば、オリゴヌクレオチドを担体から切りだし、核酸塩基とリンの保護を除去する最終切断および脱保護の工程で、脱プリン化が起こることがあります。場合によっては、脱トリチル化の際に弱い酸を使用したり、酸との接触時間を短くすることで、脱プリン化レベルを低く維持することができます1。DCAはTCAよりも穏やかな酸であるため、長いオリゴヌクレオチドの脱トリチル化に適しており、TCAよりも合成収率が高くなる傾向があります2。しかし、脱保護(脱ブロック)にTCAを使用することで、より高速な反応が可能となります。3%TCAを脱トリチル化ステップに使用した場合、酸の導入時間が10秒と短くても(110秒に対して)、全長の生成物の収率を大きく損なわないことが研究で示されています3。
1分未満で完了するデブロッキングステップは、オリゴヌクレオチドが酸にさらされる時間を短縮するのに理想的です4。
別の方法として、脱トリチル化工程と洗浄工程を交互に行う方法があります。これにより、完全な脱保護が可能となり、酸との接触時間を最小限に抑えることができます。
重要なポイント: 最もマイルドで効果的なデブロッキング酸を使用し、最短の接触で脱プリンのリスクを低減することができます。
活性化/カップリング
デブロッキング工程が終了すると、5'-OH基は反応に自由になります。オリゴヌクレオチド配列の2番目の塩基に対応するホスホロアミダイトを活性化します。ジイソプロピリデン基は、5-エチルチオ-1H-テトラゾール(ETT)または5-ベンジルチオ-1H-テトラゾール(BTT)などの活性化剤でプロトン化されます。この活性剤はカラムに供給され、遊離の5'-OH基と反応し、ジイソプロピリデン基を置換してホスファイト結合を形成します。
4,5-ジシアノイミダゾール(DCI)は、使用可能な代替活性化剤です。DCIはETTやBTTよりも酸性度が低いが、より求核性の高い活性化剤であり、カップリング時間を短縮することができます。
DCIはアセトニトリルへの溶解性が高いため、固相合成の際にヌクレオシドホスホロアミダイトの有効濃度を高くすることができます。有効濃度が高いほど、カップリング時のホスホロアミダイト過剰量を少なくすることができます5。
カップリング効率は、特に長いオリゴヌクレオチドの収量、オリゴヌクレオチドの品質、および下流の精製プロセスの容易さを最適化するための基本的な要素です。アミダイトのカップリング効率は、カップリング時間やアセトニトリルの乾燥度など、多くの要因に影響されます。用途に応じて最も効果的な活性化剤を使用することに加え、効果的なカップリング効率を得るには、以下のような方法があります。
- カップリング工程に関与する試薬の水分を排除することです。ホスホロアミダイトを溶解する際には、希釈剤および洗浄剤として無水アセトニトリル(ACN)を使用し、無水環境を維持します。アミダイトに添加する前に、ACNをモレキュラートラップで前処理することをお勧めします。
- 固体担体を選択する際には、オリゴの長さ、複雑さ、ロードの必要性を考慮します。オリゴヌクレオチドの特性に基づいて適切な固体担体を選択することは、合成サイクルを通して高いカップリング効率を維持するために重要です。
- 長いオリゴヌクレオチドのカップリング効率を高めるためにホスホロアミダイト濃度を上げます2。
- 試薬量やカップリング時間を調整します。
- 長いオリゴの場合、キャップ/酸化/キャップ(cap/ox/cap)のサイクルを使用すると、カップリングが改善されます。これは、酸化工程の後、2回目のキャッピングで担体を乾燥させた結果であると考えられます。
キャッピング

ホスホロアミダイトカップリング後、未反応の5'-OH基をアセチル化するためにキャッピング工程が導入されます。固相ホスホロアミダイトカップリングは通常約99%の効率で進行するが、反応性の5'-OH基がキャップされないまま残っていると、望ましくない副生成物が生じることがあります。ブロックしない限り、これらの切断されたオリゴヌクレオチドは、その後の合成サイクルで反応し続け、内部欠失を伴う完全長に近いオリゴヌクレオチドを生成する可能性があります。
 キャップは一般に、無水酢酸(Cap Mix A)と、Cap Mix Aの活性化剤として働く触媒のN-メチルイミダゾール(Cap Mix B)を含む溶液を使用して達成されます。5′アセチルエステルキャップは、その後のすべての合成サイクルにおいて反応性がなく、最後の塩基脱保護工程で除去されます4。
キャップは一般に、無水酢酸(Cap Mix A)と、Cap Mix Aの活性化剤として働く触媒のN-メチルイミダゾール(Cap Mix B)を含む溶液を使用して達成されます。5′アセチルエステルキャップは、その後のすべての合成サイクルにおいて反応性がなく、最後の塩基脱保護工程で除去されます4。
キャッピングは、精製が困難で、その後のオリゴヌクレオチドの用途に効果がない欠失変異の蓄積を減らすために、合成サイクルの重要なプロセスです。キャッピング後にアセトニトリル洗浄を追加することにより、合成収率を向上させることができます4。
Mermade 192シンセサイザーのCap mix 試薬
重要なポイント:最も効率的な化学反応と最も純粋な試薬を使用しても、100%のカップリング効率を期待するのは合理的ではありません。
酸化反応
オリゴヌクレオチド合成サイクルの最終段階では、不安定な亜リン酸トリエステル結合を、THF/水/ピリジンまたはTHF/水/ルチジン溶液中でヨウ素を用いてより安定な5価の亜リン酸トリエステルに酸化します。酸化剤には水が含まれているため、この反応の後、担体はアセトニトリルで数回洗浄されます4。残留する水分を除去する最も効果的な方法は、さらにキャッピングのステップを行うことです。キャッピング試薬に含まれるピリジンやルチジンは、MeCN よりも効率的に水分を担体から除去します。
酸化が完了すると、担体に結合したオリゴヌクレオチドの5'-末端の脱トリチル化から始まる4ステップのサイクルが繰り返されます。このプロセスは、オリゴヌクレオチドの各塩基が成長する鎖に結合されるまで続けられます。
本シリーズの最終回では、合成後の処理についてご紹介します。オリゴヌクレオチド合成における切断、脱保護、精製のオプションについて学びますので、ご期待ください。
重要なポイント:酸化は合成サイクルの最終ステップですが、オリゴヌクレオチドを生物学的に活性な分子にするためには、オリゴヌクレオチドをさらに処理する必要があります。
参考文献
- Tram K, Sanghvi Y and Yan H. Further optimization of detritylation in solid-phase oligodeoxyribonucleotide synthesis. Nucleosides, nucleotides & nucleic acids. 30:12-9. https://doi.org/10.1080/15257770.2010.537291. Published 2011. Accessed August 10, 2021.
- Pollard J. Synthesis of Oligonucleotides. Department of Molecular Biology - Massachusetts General Hospital and Harvard Medical School protocols. Published 1998. Accessed August 10, 2021. https://molbio.mgh.harvard.edu/szostakweb/protocols/oligo/index.html
- Millar S, Yan H, Sanghvi YS, et al. Some observations on detritylation in solid-phase oligonucleotide synthesis. Nucleic Acids Symp. Ser. 52(1):311–312. Published 2008. Accessed August 10, 2021. https://doi.org/10.1093/nass/nrn157.
- Ellington A and Pollard J. Introduction to the synthesis and purification of oligonucleotides. Current Protocols in Nucleic Acid Chemistry. A.3C.1-A.3C.22. Published 2000. Accessed August 10, 2021. https://deepblue.lib.umich.edu/bitstream/handle/2027.42/143751/cpnca03c.pdf?sequence=1
- Vargeese C, Carter J, Yegge J, et al. Efficient activation of nucleoside phosphoramidites with 4,5-dicyanoimidazole during oligonucleotide synthesis. Nucleic Acids Research. 26(4):1046-1050. https://doi.org/10.1093/nar/26.4.1046. Published 1998. Accessed August 10, 2021.



