診断におけるアプタマーの次なる目標は?

1990年代はじめに開発されたアプタマーは、長い間、検出に用いる抗体の代替品として注目されてきました。そして2022年、アプタマーは治療薬としてだけでなく、診断薬として使われ始めています。LGC Biosearch Technologies社のチームが興奮し、診断におけるアプタマーの将来を牽引すると信じている最近のアプリケーションと技術的進歩をここでご紹介します。
モレキュラーアプタマービーコンを「and」演算子として使用し、検出時のバックグランドを低減
バックグラウンドシグナルは検出方法に関わらず、堅牢な検出アッセイを開発するうえで常に課題となります。これはエクソソームを検出、または定量しようとする場合に特に当てはまります。ほとんどの方法はエクソソーム表面にある特異的タンパク質との結合(通常は抗体による)に依存しているためです。問題は単離されたエクソームにしばしば伴う遊離タンパク質から生じ、この遊離タンパク質は検出分子と結合するため、エクソソームの定量において過大評価やバラつきが生じます。
Chenら1は、HER2陽性エクソソームを定量するためモレキュラーアプタマービーコンを用いることで、この問題に対するエレガントな解決策を考案しました。ビーコンのアプタマー部分はHER2を認識し、HER2陽性エクソソームに結合することができました。アプタマーがHER2陽性エクソソームに結合すると、ビーコンが展開し、ペルオキシダーゼ様G4-ヘミンを形成するG-quadruplex(G四重鎖、G4) DNAが露出し、エクソソームの脂質膜表面へのチラミン被覆金ナノ粒子の沈着を触媒し、表面プラズミン共鳴シグナルを幾何学的に増幅しました。
したがって、強いシグナルはHER2とエクソソーム膜の両方が存在する場合にのみ発生し、遊離HER2タンパク質からのバックグラウンドシグナルを減少させました。
マイクロ流体キャッチ&リリースのためのアプタマー
エクソソームは診断および治療用途で重要性が増しているため2-6、エクソソームは我々が楽しみにしているアプタマーストーリーのひとつになります。
抗体に対するアプタマーの大きな利点のひとつは、高塩濃度のような穏やかな条件下で結合した標的を遊離できることです。結合標的がエクソソームの場合、高塩条件下ではエクソソームは無傷のままであり、治療用途などの下流のアッセイに機能します。
Zhouら7は、これまでのアプタマービーズを用いたエクソソーム分離研究を発展させ、マイクロ流体アプタマーを用いたエクソソームシステムを開発しました。彼らはCD63とPTK7を表面に持つエクソソームを認識する2つの異なるアプタマーでマイクロ流体チャネルをコーディングし、細胞培養上清から直接、高度に定義されたサイズ分布を持つエクソソームを迅速に精製することができました。
迅速で "ダーティ"かつ高感度な検出のためのアプタマー
ELISAのようなイムノアッセイは、血液中の標的タンパク質を高感度に検出・定量するのに役立ちますが、このようなアッセイはインキュベーションや洗浄のステップが何度もあり、時間と労力を要することがあります。Yuら8は、複数の洗浄ステップを必要としない、アプタマーとモレキュラービーコンを組み合わせたアッセイ法を開発し、0.74ng/mLの検出限界(LOD)で標的である血小板由来成長因子(PDGF)を検出することに成功しました。
YuらのアッセイはPDGF標的との結合に伴うアプタマーの構造変化を利用しています。結合時に、アプタマーPDGF複合体は、モレキュラービーコンに相補的な配列を近接させ、モレキュラービーコンの結合(Cycle 1)を可能にし、Cy5蛍光体とBHQ3クエンチャーの分離によるシグナルの発生を可能にします。プライマーとニッキングエンドヌクレアーゼを加えることで、アプタマーのモレキュラービーコン結合配列を増加させるための複数回の複製が可能になり、モレキュラービーコンからのシグナルがさらに増幅されます。(図1参照)。
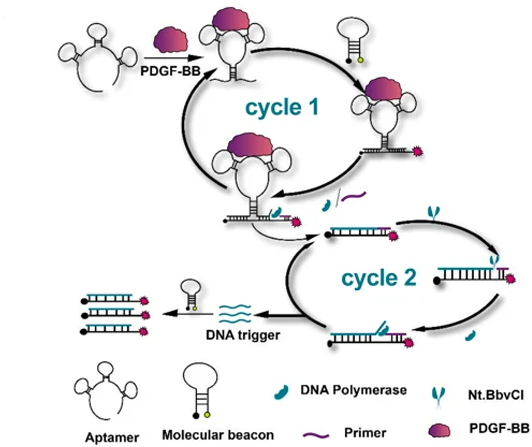 図1. Yuら8を引用しました。標的PDGF-BBとアプタマーとの結合がどのように構造変化を引き起こし、モレキュラービーコンに相補的な配列を露出させて近接させるかを示している。プライマーとニッキングヌクレアーゼ(Nt.BbvCl)を加えることで、アプタマーのモレキュラービーコン結合配列を増加させる複製を何度も繰り返すことができ、モレキュラービーコンからのシグナルがさらに増幅されます。この図の色は、原文(CC-BY-4.0)から引用しました。
図1. Yuら8を引用しました。標的PDGF-BBとアプタマーとの結合がどのように構造変化を引き起こし、モレキュラービーコンに相補的な配列を露出させて近接させるかを示している。プライマーとニッキングヌクレアーゼ(Nt.BbvCl)を加えることで、アプタマーのモレキュラービーコン結合配列を増加させる複製を何度も繰り返すことができ、モレキュラービーコンからのシグナルがさらに増幅されます。この図の色は、原文(CC-BY-4.0)から引用しました。
ハイスループット・スクリーニングと発見のためのアプタマー
アプタマーが抗体アッセイよりも優れているもう一つの例は血漿プロテオームの大規模探索です。ゲノムワイド関連研究(GWAS)を用いると、ゲノム中の塩基配列変異が血漿中のタンパク質レベルと関連することがあります。これはタンパク質量的形質遺伝子座(protein quantitative trait loci)またはpQTLと呼ばれます。これらのpQTLは、疾患経路の背後にあるメカニズムをより深く理解するのに役立ちます。
抗体ベースの方法は、循環タンパク質の測定に使用できます。しかし最近のアプタマーベースの方法の進歩により、膨大な数のタンパク質を測定できるようになり、生物学的経路を広範囲にカバーできるようになりました。
Ferkingstadら9は、SomaScanマルチプレックスアプタマーアッセイを使用して、アイスランド人35,559人の4,907個の血漿タンパク質を測定し、2,720万個の配列変異と373の疾患やその他の形質との関連性を分析することによってpQTLを新たなレベルに引き上げました。これまでの他の研究よりもはるかに大規模なこの研究によって、彼らは潜在的な創薬標的をコードする938の遺伝子を同定し、最終的には創薬を支援する貴重なリソースを提供しました。
診断における新しいアプタマーのイノベーションに期待
強力ではありますが、研究者がアプタマーの診断への大きな可能性を完全に理解し始めるまでには数十年を要しました。モレキュラービーコン、ブラックホールクエンチャー、マイクロ流体工学などの関連技術の進歩を必要としました。またYuら8の研究のように、二本鎖DNA結合と組み合わせた3D立体構造を最大限に活用する創造的なアプローチも必要でした。特に過去数年間のこのような強力なイノベーションを基盤として、今後数年間でさらにエキサイティングな取り組みが行われることが期待されます。
当社関連製品
Black Hole Quencher, BHQ-3グリコール酸塩 CPG
参考文献
- Chen W, Li Z, Cheng W, et al. Surface plasmon resonance biosensor for exosome detection based on reformative tyramine signal amplification activated by molecular aptamer beacon. J Nanobiotechnology. 2021;19:450. doi:10.1186/s12951-021-01210-x7
- M2. Yang J, Shin TS, Kim JS, Jee YK, Kim YK. A new horizon of precision medicine: combination of the microbiome and extracellular vesicles. Exp Mol Med. Published online April 22, 2022. doi:10.1038/s12276-022-00748-6
- Shetgaonkar GG, Marques SM, DCruz CEM, Vibhavari RJA, Kumar L, Shirodkar RK. Exosomes as cell-derivative carriers in the diagnosis and treatment of central nervous system diseases. Drug Deliv Transl Res. 2022;12(5):1047-1079. doi:10.1007/s13346-021-01026-0
- Ghafourian M, Mahdavi R, Akbari Jonoush Z, et al. The implications of exosomes in pregnancy: emerging as new diagnostic markers and therapeutics targets. Cell Commun Signal CCS. 2022;20(1):51. doi:10.1186/s12964-022-00853-z
- Guo Y, Gil Z. The Role of Extracellular Vesicles in Cancer-Nerve Crosstalk of the Peripheral Nervous System. Cells. 2022;11(8):1294. doi:10.3390/cells110812945
- A6. Tan Y, Tang F, Li J, et al. Tumor-derived exosomes: the emerging orchestrators in melanoma. Biomed Pharmacother Biomedecine Pharmacother. 2022;149:112832. doi:10.1016/j.biopha.2022.112832
- Zhou Z, Chen Y, Qian X. Target-Specific Exosome Isolation through Aptamer-Based Microfluidics. Biosensors. 2022;12(4):257. doi:10.3390/bios12040257
- Yu Q, Zhai F, Zhou H, Wang Z. Aptamer Conformation Switching-Induced Two-Stage Amplification for Fluorescent Detection of Proteins. Sensors. 2018;19(1):77. doi:10.3390/s19010077
- Ferkingstad E, Sulem P, Atlason B, et al. Large-scale integration of the plasma proteome with genetics and disease. Nature Genetics. 2021; 53(12), 1712-1721. doi:10.1038/s41588-021-00978-w



