次世代の疾病管理を担う核酸治療薬

本ブログは、オリゴヌクレオチドの修飾が核酸治療薬の発展をどのようにサポートするかを探る記事です。2回目のブログでは、核酸を治療薬として使用するために利用できる技術や化学修飾について説明します。
研究者たちは20年以上にわたって核酸治療を研究してきましたが、COVID-19のmRNAワクチンが臨床デビューしたことで、近年より注目を集めるようになりました。核酸医薬の技術は、現在の薬物療法では対処できない病気の治療に有望ですが、より広い応用を目指すにはいくつかの課題が立ちはだかっています。
核酸医薬とは?
長年の研究の結果、核酸は現在、低分子化合物や抗体に続く第三の創薬プラットフォームとして認識されています1。核酸医薬は、合成オリゴヌクレオチドを用い、遺伝子の阻害、付加、置換、編集により、長期的な治療効果を実現するものです2。つまり遺伝子の発現を調節することで、タンパク質の生産を停止したり刺激を与えたりして、望ましい治療効果を得ることができます。この遺伝子操作は、タンパク質を標的として治療効果を発揮する従来の医薬品とは異なる作用機序を有しています2。
化学的に修飾されたアンチセンスオリゴヌクレオチド(ASO)、N-アセチルガラクトサミン(GalNAc)リガンド修飾短鎖干渉RNA(siRNA)のコンジュゲート製剤、脂質ナノ粒子(LNPs)、アデノ随伴ウイルス(AAV)ベクターという4つのプラットフォーム技術は、承認済みまたは後期段階の臨床核酸治療候補薬の大半を支えています2。ASOとsiRNAは、核DNAのmRNAへの転写とmRNAのタンパク質への翻訳を阻害することにより治療効果をもたらし、遺伝子を改変することなく効果的に不活性化します3。
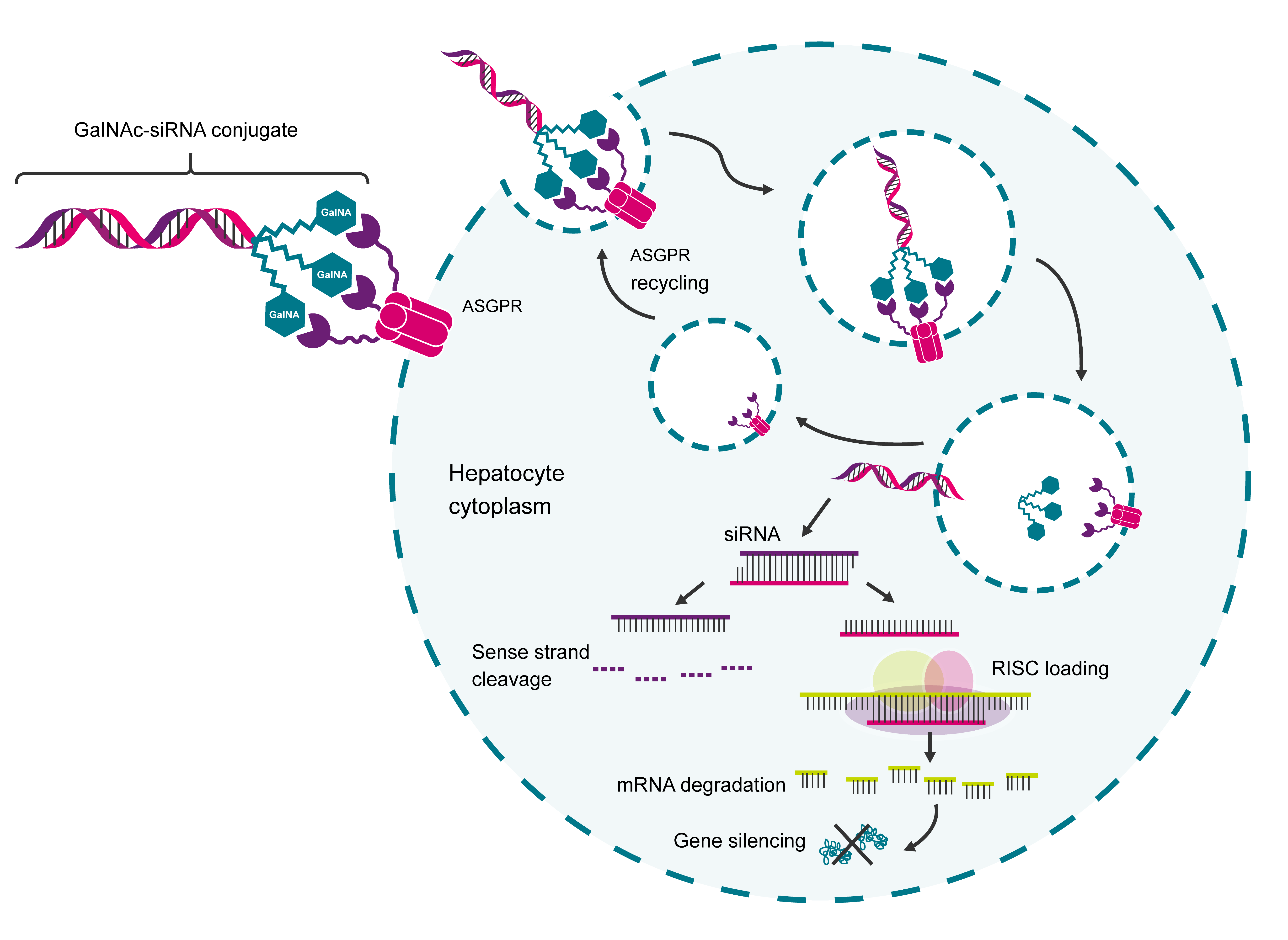
図1. RNAベースの治療薬を肝臓内に送達するGalNAcコンジュゲートの描写。GalNAcは、肝臓に高度に発現しているアシアロ糖タンパク質受容体(ASPGR)に高い親和性と特異性をもって結合し、その結果、肝細胞への取り込みが顕著になります。肝細胞に取り込まれた後、結合体は細胞内に留まり、ASGPRは細胞表面にリサイクルされるため、強力かつ効率的に肝臓への治療薬の送達を行うことが可能となります。
現在承認されている核酸医薬のほとんどは希少疾患の治療薬ですが、そのデリバリー技術を活用すれば、がん、心血管疾患、血友病など、より一般的な疾患の治療法を探ることができます4。このように将来が期待できる核酸医薬ですが、その普及には課題が立ちはだかっています。より広範な臨床応用のためには、製造上の障害、毒性の問題、経済的な障壁を克服する必要があります2。
核酸医薬品の製造上の課題
核酸は、ヌクレアーゼによる分解を受けやすく、細胞への導入が困難で、免疫反応に寄与するため、治療への応用が困難です2。核酸医薬の効果的な臨床的成功のためには、合成オリゴヌクレオチドの安定性や内在性、標的親和性に関する技術の改善が必要です2。
細胞内の酵素は、核酸治療薬にとって大きな脅威となります。エンドヌクレアーゼやエキソヌクレアーゼは、DNAおよびRNA分子のホスホジエステル架橋を攻撃し、それらをモノヌクレオチドに分解します。その結果、未修飾オリゴヌクレオチドは治療用途に使用できなくなります5。疾患治療に適した機能的なオリゴヌクレオチドを作るには、細胞内で細胞内のヌクレアーゼによる分解に対して十分な抵抗性を持つように設計する必要があります。
核酸を効率的に細胞に送達することは、研究者にとって最も重要な課題の一つです。RNAベースの治療薬は比較的大きく、陰イオン性の高い分子であるため、細胞膜を通過して拡散することが困難です。単体で細胞に入ることができないため、細胞内を移動するための送達剤に頼らなければなりません。さらに、オリゴヌクレオチドは腎臓による濾過や非標的細胞による取り込みを避ける必要があります。
RNAベースの医薬品の標的細胞への送達は、標的外の臓器への蓄積を減らすために必要であり、肝臓以外の組織では依然として課題となっています3。 特にASOは、腎臓、肝臓、脾臓に濃縮され、毒性をもたらします。最適化された送達プラットフォームは、ASOの必要投与量を減らし、効率を高め、組織特異的なターゲティングを可能にして、毒性を最小限に抑えることができます6。 これらの問題を解決するための細胞送達プラットフォームが現在いくつか使用されていますが、産業規模での実用化においては、拡張性と再現性に限界が生じる可能性があります6。
治療への応用を可能にする
幸いなことに、核酸を治療用途に使用する際に生じるいくつかの課題に対処するための化学修飾や技術が利用可能です。これらの修飾は、ヌクレアーゼ耐性を付与し、安定性と標的結合親和性を向上させ、より効率的な細胞送達と取り込みを促進することができます2。
第2回目のブログでは、治療への応用を可能にする化学修飾について詳しくご紹介します。
参考文献
- Juliano R. The delivery of therapeutic oligonucleotides. Nucleic Acids Research, 44 (14): 6518-6548. Published August 2016. Accessed 01 September 2021. https://doi.org/10.1093/nar/gkw236
- Kulkarni JA, Witzigmann D, Thomson SB, et al.The current landscape of nucleic acid therapeutics. Nanotechnol. 16, 630–643. Published May 2021. Accessed 01 September 2021. https://doi.org/10.1038/s41565-021-00898-0
- The expanding frontier of nucleic acid therapeutics. Accessed 03 September 2021. https://www.nature.com/articles/d42473-021-00174-8
- Peters J. Haven’t heard of RNA therapy yet? You will. Massive Science.Published August 2018. Accessed 03 September 2021. https://massivesci.com/articles/rna-therapy-treatments/
- Gewirtz AM, Sokol DL, Ratajczak MZ. Nucleic acid therapeutics: state of the art and future prospects. Blood. 92 (3): 712–736. Published August 1998. Accessed 01 September 2021. https://doi.org/10.1182/blood.V92.3.712
- Dhuri K, Bechtold C, Quijano E, et al. Antisense oligonucleotides: an emerging area in drug discovery and development. Journal of Clinical Medicine. 9(6) 2004. Published June 2020. Accessed 25 August 2021. https://doi.org/10.3390/jcm9062004



